タンパク質 - 酵素:体内のタンパク質 - 酵素の役割、性質、機能
すべての生きている細胞には多くがあります化学反応。酵素(酵素)は、特別で非常に重要な機能を持つタンパク質です。それらは生体触媒と呼ばれています。体内のタンパク質酵素の主な機能は、生化学反応を加速することです。相互作用がこれらの分子によって触媒される初期試薬は基質と呼ばれ、最終化合物は生成物である。
自然界では、酵素タンパク質は生きているシステム。しかし、現代のバイオテクノロジーでは、臨床検査、医薬品、医薬品、精製された酵素またはそれらの複合体、ならびに研究者のためのシステム操作およびデータ視覚化に必要な追加コンポーネントが使用される。
生物学的意義と酵素の性質
これらの分子がなければ、生きている生物は機能する。すべての生命過程は酵素のおかげで一緒に働く。体内のタンパク質 - 酵素の主な機能は、代謝の調節である。それらがなければ、正常な代謝は不可能である。分子の活性の調節は、活性化因子(インデューサー)またはインヒビターの作用下で起こる。対照は、異なるレベルのタンパク質合成で機能する。彼はすでに準備ができている分子のために "働く"こともあります。
タンパク質 - 酵素の主な特性 - 特異的基質に対する特異性を有する。したがって、1つの、またはまれにしか一連の反応を触媒する能力がない。通常、そのようなプロセスは可逆的です。両方の酵素が両方の機能を担う。しかしそれだけではありません。

タンパク質 - 酵素の役割は必須である。 それらがなければ、生化学反応は起こらない。酵素の作用により、試薬は有意なエネルギー消費なしに活性化バリヤーを克服することが可能である。体内では、温度を100℃以上に加熱することや、化学実験室のような積極的なコンポーネントを使用することはできません。タンパク質 - 酵素は基質と結合する。縛られた状態では、修正があり、その後に修正があります。これは、化学合成に使用されるすべての触媒がどのように機能するかです。
タンパク質 - 酵素分子の組織化のレベルは何ですか?
通常、これらの分子は、第3(小球)または四次(いくつかの連結小球)タンパク質構造。まず、それらは線形形式で合成されます。そして、必要な構造に折り重ねます。活性を確実にするために、生体触媒は特定の構造を必要とする。
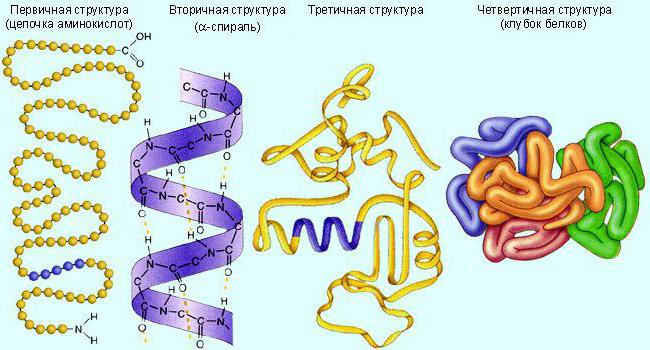
酵素は他のタンパク質と同様に、加熱、極端なpH値、攻撃的な化合物によって破壊されます。
酵素の付加的性質
その中で、コンポーネントの以下の特徴が区別されます。
- 立体特異性 - 1つの生成物の形成。
- 位置選択性は、化学結合の破壊または1つの位置における基の修飾である。
- 化学選択性は、1つの反応のみの触媒反応である。
仕事の特徴
酵素の特異性のレベルは様々である。 しかし、いずれの酵素も、構造が類似している特定の基質または化合物群に関して常に活性である。非タンパク質触媒はこの性質を有さない。特異性は結合定数(mol / l)によって測定され、これは10に達することができる-10 モル/ l。活性酵素の作用は迅速である。 1分子は1秒間に数千万の操作を触媒する。生化学反応の加速の程度は、従来の触媒のそれよりも有意に(1000〜100000倍)高い。
酵素の作用は、いくつかのメカニズム。最も単純な相互作用は、基質の1つの分子と起こり、続いて生成物が形成される。ほとんどの酵素は、反応に入る2〜3の異なる分子に結合することができる。例えば、1つの接続から別の接続へのグループまたはアトムの転送または「ピンポン」の原理による2重の置換。これらの反応では、1つの基質が通常連結され、第2の基質は官能基を介して酵素に結合される。
酵素の作用機序は、以下の方法を用いて研究される:
- 中間製品および最終製品の定義。
- 基板に関連する構造および官能基の幾何学的構造および高い反応速度の研究。
- 酵素遺伝子の突然変異およびその合成および活性の変化を測定する。
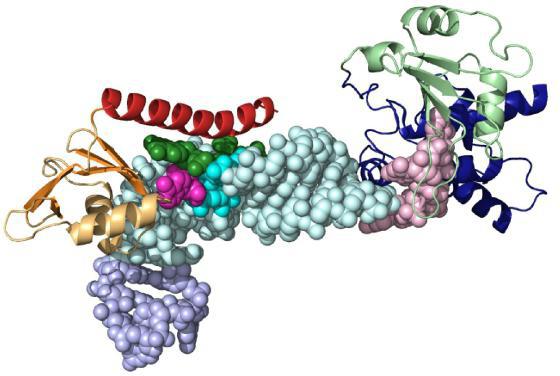
アクティブな拠点
基板の分子は、サイズがはるかに小さく、タンパク質酵素よりも優れている。従って、生体触媒の少数の官能基のために結合が起こる。それらは、アミノ酸の特定のセットからなる活性中心を形成する。構造中の複雑なタンパク質には、活性中心の一部であり得る非タンパク質性の補綴群が存在する。
別々の酵素群を選別する必要があります。 それらは分子中に補酵素が常に存在し、そこから放出されます。完全に形成されたタンパク質酵素はホロ酵素と呼ばれ、補因子が除去されるとアポ酵素と呼ばれる。補酵素はしばしばビタミン、金属、窒素塩基の誘導体(NAD-ニコチンアミドアデニンジヌクレオチド、FAD-フラビナデニンジヌクレオチド、FMN-フラビンモヌクレオチド)である。

バインディングセンターは特異性を提供する基板に対する親和性。これにより、安定した基質 - 酵素複合体が形成される。小球の構造は、基材の結合を確実にする一定の大きさのニッチ(間隙または空洞)を表面に有するように構成されている。このゾーンは通常、アクティブセンターから遠くに位置していません。個々の酵素は補因子または金属イオンとの結合のための部位を有する。
結論
タンパク質酵素は体内で重要な役割を果たします。 このような物質は、化学反応を触媒し、代謝過程 - 代謝に関与する。生きている細胞では、化合物の還元反応、分裂および合成を含む何百もの生化学的プロセスが常に起こっている。大きなエネルギー放出を伴う物質の酸化は常に起こっている。それは、次に、炭水化物、タンパク質、脂肪およびその複合体の形成に費やされる。切断生成物は、必要な有機化合物を合成するための構造要素である。