化合物の反応。化合物反応の例
それが不可能な多くのプロセス我々の人生(呼吸、消化、光合成など)を表現することは、有機化合物(および無機物)の様々な化学反応と関連している。その主なタイプを見てみましょう。次に、接続(接続)というプロセスについて詳しく説明します。
いわゆる化学反応
まず第一に、これの一般的な定義を与える価値がある現象。考察中のフレーズによって、異なる複雑さの物質の様々な反応が意味され、その結果、最初の生成物から異なる生成物が形成される。このプロセスに関与する物質は、「試薬」と呼ばれます。

手紙では、有機物の化学反応化合物(および無機物)は特殊な方程式を使って書かれています。外側には、数学的な加算の例が少しあります。ただし、記号( "=")の代わりに矢印( "→"または "⇆")が使用されています。さらに、方程式の右辺には左辺よりも多くの物質が存在することがあります。反応が始まる前に物質が矢印の手前にあります(式の左側)。それが後ろにあるもの(右側) - 起こった化学プロセスの結果として形成される化合物。
化学式の一例として、電流の作用下での水の水素と酸素との反応を考えることができる:2H2О→2H2↑+について2↑。水は出発試薬であり、水素との酸素は生成物である。
1つ以上、より複雑なもの化合物の化学反応の一例は、少なくとも一度はお菓子を焼いたすべてのホステスにとってよく知られている現象と考えることができる。それはテーブル酢の助けを借りてベーキングソーダを消す問題です。その作用は、以下の式によって示される:NaHCO3 +2СН3COOH→2CH3COONa + CO2↑+ H2A.このことから、酢酸、水および二酸化炭素のナトリウム塩が、炭酸水素ナトリウムと酢との相互作用の間に形成されることが明らかである。
その性質上、化学プロセスは、物理的なものと核的なものの中間的な場所を占めています。
最初のものとは異なり、化学物質に参加する化合物の反応はそれらの組成を変えることができる。すなわち、ある物質の原子から、水の分解のための前述の式のように、いくつかの物質が形成され得る。
核反応とは異なり、化学反応は相互作用する物質の原子核に影響を与えません。
化学プロセスの種類は何か
種による化合物の反応の分布は、異なる基準に従って起こる:

- 可逆性/不可逆性。
- 触媒作用物質およびプロセスの存在/非存在。
- 熱の吸収/放出について(吸熱/発熱反応)。
- 相数:均質/異種およびそれらの2つのハイブリッド品種。
- 相互作用する物質の酸化の程度を変えることによって。
相互作用の方法による無機化学における化学過程の種類
この基準は特別です。その助けを借りて、化合物、置換、分解(開裂)、交換の4種類の反応が区別されます。
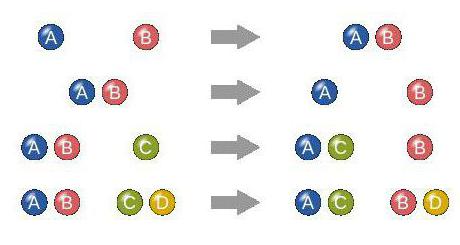
それぞれの名前はプロセスに対応していますが、彼女はそれについて説明します。すなわち、化合物において、物質は、置換されて、置換され、他のグループに変更され、それらのいくつかは、1つの試薬からの分解において形成され、そして交換において、反応の参加者は、原子によってそれらの間で変化する。
有機化学における相互作用の方法によるプロセスの種類
大きな複雑さにもかかわらず、有機化合物の反応は無機化合物と同じ原理で起こる。ただし、いくつかの異なる名前があります。
したがって、化合物および分解反応は、「付加」、ならびに「分割」(排除)および直接的な有機分解(化学のこのセクションでは2つのタイプの開裂プロセスがある)を含む。
有機化合物の他の反応は、代替(名前は変わらない)、再グループ化(交換)および酸化還元プロセスが含まれる。彼らのメカニズムの類似性にもかかわらず、オーガニックではより汎用性があります。
化合物の化学反応
有機化学や無機化学の物質を含むさまざまなプロセスを考えた上で、より詳細に接続することが重要です。
この反応は、開始時の試薬の量にかかわらず、最終段階ではすべてが1つに結合するという点で他の全ての反応とは異なる。
一例として、石灰を急冷するプロセスを思い出すことができます:CaO + H2O→Ca(OH)2。この場合、化合物酸化カルシウム(生石灰)と酸化水素(水)。その結果、水酸化カルシウム(消石灰)が形成され、暖かい蒸気が放出される。ところで、これはこのプロセスが本当に発熱性であることを意味します。
化合物
概略的に検討中のプロセスは可能ですA + BV→ABCのようになります。この式において、ABCは新たに形成された複合物質であり、Aは単純な試薬であり、BVは複合化合物の変形物である。
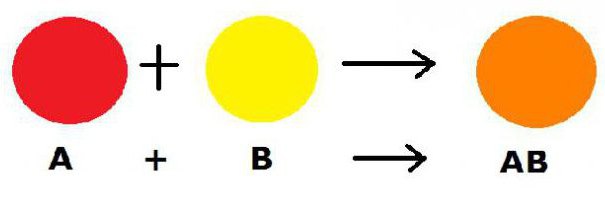
この公式は、追加および接続のプロセスにも特徴的であることに留意すべきである。
検討されている反応の例は、酸化ナトリウムと二酸化炭素(NaO2 + CO2↑(t 450-550℃)→Na2CO3)、酸素と硫黄の酸化物(2SO2 + O2↑→2SO3)。
また、いくつかの化合物は互いに反応することができる:AB + VH→ABHG。例えば、すべて同じ酸化ナトリウムおよび酸化水素:NaO2 + H20→2NaOH。
無機化合物における反応条件
前の式に示されているように、様々な程度の複雑さの物質が考慮中の相互作用に入り込む可能性があります。

この場合、無機起源の単純な試薬については、化合物(A + B→AB)の酸化還元反応が可能である。
一例として、塩化第二鉄を得るプロセスを考えることができる。このために、化合物と塩素と鉄(鉄)との反応を行う:3Cl2↑+ 2Fe→2FeCl3.
ケースでは、無機物質(SH + AB→ABCD)の複雑な相互作用であり、プロセスが影響またはそれらの原子価に影響を及ぼさないように発生することができます。
これに対する実例として、二酸化炭素、酸化水素(水)酸化物および白色食用着色料E170(炭酸カルシウム)からの炭酸水素カルシウムの形成の例を考えるべきである:CO2↑+ H2O + CaCO3 →Ca(CO3)2. この場合、化合物の古典的な反応が起こる。それが実行されると、試薬の価数は変化しない。
わずかに完璧な(最初の)化学式2FeCl2 + C 12↑→2FeCl3 単純な無機試薬と複雑な無機試薬(ガス(塩素)と塩(塩化第二鉄))の相互作用における酸化還元プロセスの例です。
有機化学における付加反応の種類
第4段落に既に示されているように、有機起源の物質である場合、当該反応は「所属」と呼ばれる。原則として、二重(または三重)結合を有する複雑な物質を含む。
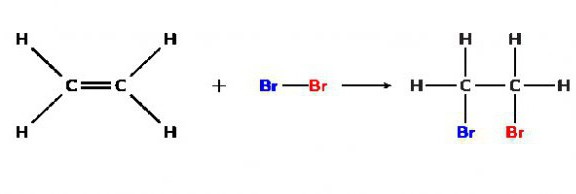
例えば、1,2-ジブロモエタンの生成をもたらすジブロモとエチレンとの間の反応:(C2H4)CH2= CH2 + Br2 →(C2H4Br2)BrCH2 - CH2Br。 ところで、この式の等号と否定記号( "="と " - ")に類似した記号は、複雑な物質の原子間のつながりを示しています。これは有機物の公式を書くことの特徴です。
化合物のどれが試薬として作用するかに応じて、いくつかの種類の付着プロセスが区別される:
- 水素化(多重結合上に水素分子Hを加える)。
- ハロゲン化水素(ハロゲン化水素が結合している)。
- ハロゲン化(Brハロゲンの添加2, Cl2↑など)。
- 重合(高分子量物質のいくつかの低分子化合物からの形成)。
付加反応(化合物)としては、
考慮中のプロセスの品種を列挙した後、実際に化合物の反応のいくつかの例を学ぶことは有益である。
例示として、水素化は水素とプロペンとを反応式に注意を引くことができ、それによってそこプロパン(C3H6↑)CH3-CH = CH2↑ + H2↑ →(C3H8↑)CH3-CH2-CH3↑.
有機化学において、化合物の反応(添加)は塩酸(無機物質)とエチレンとの間でクロロエタンの形成を伴って起こり得る:(C2H4↑)CH2= CH2↑+ HCl→CH3 - CH2-Cl(C2H5Cl)。 提示された式は、ハロゲン化水素の例である。

ハロゲン化に関しては、1,2-ジクロロエタンの形成につながるジクロロとエチレンとの間の反応によって説明することができる:(C2H4↑)CH2= CH2 + C 12↑→(C 2 H 4 Cl 2)ClCH2-CH2Cl。
多くの有用物質が形成される有機化学のおかげです。紫外線の影響下でのエチレン分子の化合物(結合)と重合のラジカル開始剤との反応は、2 = CH2 (RおよびUV光)→(-CH2-CH2 - )n。このようにして形成された物質は、ポリエチレンの名のもとにすべての人によく知られています。

この素材からは異なるタイプになりますパッケージ、袋、道具、パイプ、断熱材などを含む。この物質の特徴はリサイクルの可能性である。その人気は、環境保護主義者がそれを否定するため、分解しないという事実のためにポリエチレンです。しかし、近年、ポリエチレン製品の安全な廃棄方法が見出されている。このために、材料を硝酸(HNO3)。その後、ある種の細菌はこの物質を無害な成分に分解することができます。
化合物の反応(添加)は重要な役割を果たす自然と人間の生活における役割。さらに、それはしばしば様々な重要な研究のための新しい物質を合成するために研究所の科学者によって使用されています。




