電子構成 - 原子の構造の秘密
1910年の秋、エルンスト・ラザフォード、瞑想し、原子の内部構造を理解しようとしました。さまざまな物質によるアルファ粒子の散乱に関する彼の実験は、原子の中にはこれまで知られていなかった巨大な体が存在することを説得力を持って証明しました。 1912年に、ラザフォードはそれを原子核と呼ぶだろう。科学者の頭には何千もの質問が集まった。この未知の体の代償は何ですか?重量を確保するために必要な電子の量は?

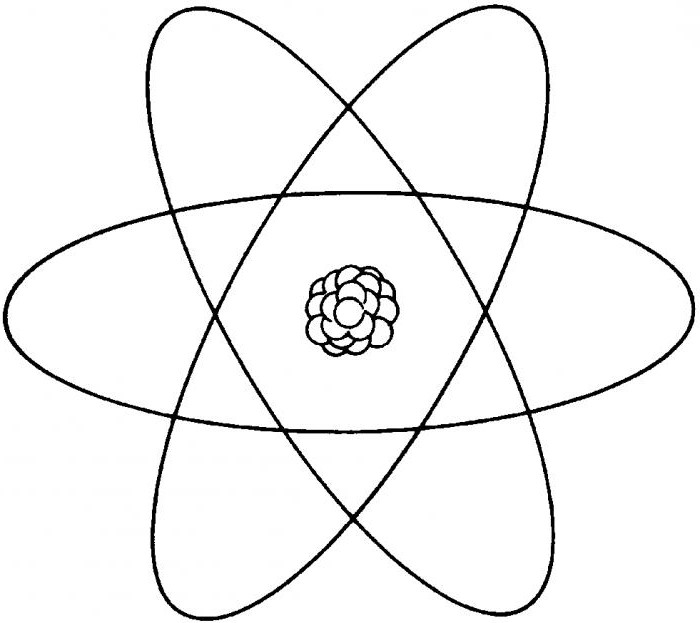
1911年5月、ラザフォードは原子構造の安定性は、原子の内部構造およびその主要な構造成分である荷電粒子の運動の機微に依存する可能性があることが非常に重要な注意点を先行原子構造。そこで電子構成が生まれました。それは原子核の原子モデルです。このモデルは、核物理学において非常に重要な役割を果たすことを目的としていました。

電子構成は順序です原子軌道の電子の分布。彼の考えを守ることができた好奇心旺盛な心と忍耐アーネスト・ラザフォード、のおかげで、科学はの重要性を強調しすぎることはできない、新しい知識と豊かされています。
原子の電子配置は以下の通りである。 構造全体の中心には、物質ごとに異なる数の中性子と陽子からなる核がある。何が核の正電荷を決定するか。対応する同心円上の軌道でその周りに電子が移動します - 負に帯電した素粒子。これらの原子軌道はシェルとも呼ばれます。原子の外側の軌道は原子価と呼ばれます。そしてその上の電子の数は原子価です。
要素の各電子構成それに含まれる電子の数によって異なる。例えば、宇宙で最も単純な物質の原子 - 水素 - は1つの単一電子のみを含み、酸素原子は8であり、鉄の電子配置は26電子を有する。
しかし、電子モデルにおける決定値原子は電子の数はまったく持っていませんが、それらを一緒に保持し、システム全体が適切に機能するようにします - 核とその組成。それは、物質にその個々の性質および特性を与えるコアである。電子は時々原子モデルを離れ、原子は正の電荷を得る(核電荷のおかげで)。この場合、その物質はその性質を変えない。しかし、コアの組成を変更すると、それは異なる性質を持つ全く異なる物質になります。これは簡単ではありませんが、それでも可能です。

電子構成は不可能であるため、その主な構造要素 - 原子核、それは特別な注意を払う必要があります。それは、あらゆる化学物質の個々の特性および特性を形成する原子モデルの中心要素です。陽子は、実際に核に正の電荷を与え、いずれの電子よりも1840倍重い。しかし、陽子の電荷の力はどの電子の力とも等しい。平衡状態では、原子中のプロトンの数は電子の数に等しい。この場合、核はゼロ電荷のキャリアである。
原子核のもう一つの重要な粒子は、中性子と呼ばれています。連鎖的な核反応を可能にするのは電荷を持たないのがこの要素です。したがって、中性子の価値を過大評価することは、単に不可能です。