アルケンの最初の代表はエチレンである。エチレンの物性、製造、用途
不飽和炭化水素の明るい代表 - エテン(エチレン)である。物理的性質:無色可燃性ガス、酸素および空気との混合物中での爆発性。かなりの量において、エチレンは、有価な有機物質(一価および二価アルコール、ポリマー、酢酸および他の化合物)のその後の合成のために油から製造される。
相同系列のエチレン、sp2 - ハイブリダイゼーション

炭化水素は、エテノームと同様の構造および性質を有し、アルケンと呼ばれる。歴史的に、このグループの別の用語であるオレフィンは修正されました。一般式CnH2n 物質群全体の組成を反映しています。 その最初の代表は、炭素原子が3つではなく、水素との2つのx-結合のみを形成する分子中のエチレンである。アルケン - 不飽和または不飽和化合物、それらの式C2H4。形とエネルギーが2 pと1のみが混合されている炭素原子のs-電子雲が合計3つのx-結合を形成する。この状態をsp2-ハイブリダイゼーションと呼びます。炭素の第4価は保存され、分子中にはπ結合が存在する。構造式では、構造的特徴が反映されています。しかし、回線上のさまざまな種類の通信を指定するための記号は、通常同じように使用されます - ダッシュまたはドット。エチレンの構造は、異なるクラスの物質との活性相互作用を決定する。水および他の粒子の添加は、弱いπ結合の破裂によるものである。遊離原子価は、酸素、水素、ハロゲンの電子のために飽和している。
エチレン:物質の物理的性質
エテン(通常の大気18℃の圧力および温度)は無色の気体である。それは甘い(穏やかな)匂いがあり、その吸入は人に麻薬効果を及ぼす。 -169.5℃での治療は、同じ温度条件下で溶ける。エタンは-103.8℃で沸騰する。 540℃に加熱すると発火する。ガスがよく燃え、炎が輝いて、かすかな煤があります。エチレンはエーテルとアセトンに溶解し、水とアルコールははるかに少なくなります。物質の丸められたモル質量は28g / molである。相同系列のエテンの第3および第4の代表は気体物質でもある。第5およびそれ以降のアルケンの物理的特性は異なり、それらは液体および固体である。
エチレンの調製と性質
ドイツの化学者Johann Becherが誤って使用した濃硫酸実験におけるエチルアルコール。これはエテンが実験室の条件(1680)で得られた初めてのことであった。 XIX世紀中頃、A.M. Butlerovはこの化合物にエチレンという名称をつけた。物理的性質および化学反応は、有名なロシア化学者によっても記載されている。 Butlerovは物質の構造を反映する構造式を提案した。実験室でそれを得る方法:

- アセチレンの触媒的水素化。
- 加熱時の強塩基(アルカリ)の濃アルコール溶液との反応におけるクロロエタンの脱ハロゲン化水素。
- エチルアルコール分子からの水分の脱水(脱水)。この反応は、硫酸の存在下で行われる。その式は:H2C-CH2-OH→H2C = CH2 + H2O
工業生産:
- 油処理 - 炭化水素原料の分解および熱分解;
- 触媒の存在下でのエタンの脱水素化。 H3C-CH3 →H2C = CH2 + H2
エチレンの構造は、その典型的な化学反応を説明しています。それは、C原子による粒子の多重結合での付加です。
- ハロゲン化およびハロゲン化水素化。これらの反応の生成物はハロゲン化誘導体である。
- 水素化(水素による飽和)、エタンの生成。
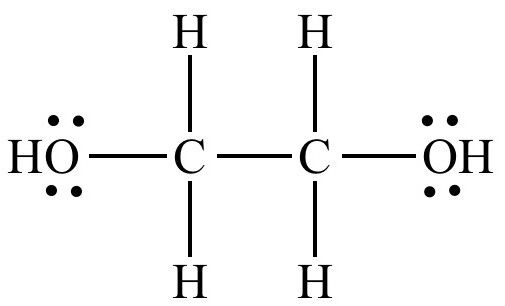
- 二価アルコールエチレングリコールへの酸化。その式:OH-H2C-CH2-OH。
- スキーム:n(H 2 C = CH 2)→n(-H 2 C-CH 2 - )による重合。

エチレンの用途
大量の油を分留する場合エチレンが得られる。物質の物理的性質、構造、化学的性質は、エチルアルコール、ハロゲン化誘導体、アルコール、酸化物、酢酸および他の化合物の製造においてそれを使用することを可能にする。エチレンはポリエチレンモノマーであり、ポリスチレンのための出発化合物である。
エテンと塩素から得られるジクロロエタンは、PVC(PVC)の製造に使用される良溶媒である。低圧と高圧のポリエチレンは、フィルム、パイプ、皿、ポリスチレン - CDケースと他の詳細で作られています。 PVCは、リノリウムの基礎であり、防水性のレインコートです。農業では、収穫前に果実を処理して成熟を促進します。